L'atmosfera che circonda la terra è un'enorme massa di gas, sempre in movimento, dai capricci della quale dipendono cose importanti come inondazioni o siccità, ma anche cose più "banali" come un'altra domenica di pioggia oppure uno stupendo giorno di volo. La meteorologia osserva e studia queste masse gassose con lo scopo di comprenderne i meccanismi e di prevederne le evoluzioni.
Più precisamente è possibile distinguere quattro "discipline", fortemente connesse, che si occupano di argomenti differenti.
La meteorologia vera e propria, che studia i movimenti delle grandi masse, è quella più nota: effettua previsioni a livello mondiale o continentale, può dirci molto sull'evoluzione generale del tempo, ma poco o nulla su ciò che accade in singole località.
Più interessante, per noi, è l'aerologia, che si occupa di masse d'aria più piccole (fino a qualche chilometro) e ne studia il comportamento in condizioni particolari (interazioni tra vento e rilievi, formazione dei singoli cumuli, eccetera).
Scendendo ancora incontriamo la microclimatologia, che studia gli strati più bassi dell'aria (fino a qualche
decina di metri dal suolo): come vedremo è la microclimatologia che ci spiega come e perchè si formano e si
distaccano le termiche, come mai esistono le brezze di valle e di mare, e così via.
Infine, cambiando registro, esiste la climatologia, che si riferisce invece a regioni o nazioni specifiche delle
quali studia le particolarità tipiche delle zone considerate. è molto importante anticipare che, per il
vololiberista, esistono (almeno) due differenti ragioni per studiare la meteorologia globalmente intesa: sicurezza e
praticità.
La prima è connessa con la sicurezza del volo e con la sopravvivenza stessa del pilota. Come abbiamo già visto, infatti, le ali da Volo Libero hanno raggiunto un grado di sicurezza strutturale più che soddisfacente per l'impiego cui sono destinate. Non possono, però, essere considerate "sicure in assoluto" (nemmeno un Boeing in un forte temporale lo è). Consentono invece di volare in un ambito preciso e definito di condizioni meteorologiche e aereologiche, che bisogna pertanto conoscere bene.
Anticipiamo subito quali condizioni non sono compatibili con il Volo Libero:La seconda ragione per studiare la meteorologia, invece, è connessa con aspetti di praticità: è un peccato preparare un bel volo e recarsi al decollo per poi accorgersi che le possibilità sono scarse o inesistenti. Si tratta dunque della capacità di prevedere il tempo: da questo punto di vista la meteorologia può dirci molto, ma non tutto; in particolari momenti il nostro ambiente è ancora imprevedibile, ed in larga misura imprevisto; tuttavia, armati delle poche nozioni esposte qui di seguito, leggendo spesso le cartine bariche ed osservando l'evoluzione delle giornate, chiunque può conoscere meglio le condizioni meteo della sua zona e ridurre notevolmente il numero di "errori" di valutazione (in altre parole ci si può costruire una certa reputazione agli occhi del vicino di casa medio).
Come già facemmo per l'aerodinamica, anche per lo studio della meteorologia dobbiamo acquisire una serie di definizioni e di termini prima di poter entrare nel "vivo" della materia.
L'abbiamo conosciuta in aerodinamica e diremo solo che quella atmosferica ha un valore medio di 760 mm di Mercurio (mm/Hg), quando misurata sul livello del mare. Nel 1914 si introdusse il millibar (mb): i 760 mm Hg corrispondono a 1013 mb (per passare dalla prima alla seconda misura basta applicare un fattore di 4/3). Più recentemente ha fatto la sua comparsa un'altra (e speriamo ultima) unità di misura, che ha valore internazionale: il Pascal (Pa). Siccome si tratta di un'unità "piccola", viene usato l'ectopascal (hPa) pari a 100 Pascal. Per fortuna 1 ectopascal corrisponde ad 1 millibar, e le conversioni sono dunque molto semplici.
Lo strumento che misura la pressione è il barometro, il cui funzionamento è trattato nel capitolo che parla degli strumenti di volo (l'altimetro è un barometro!).

Figura 4-1. La pressione atmosferica esercita il suo effetto su tutte le superfici.
La temperatura esprime l'energia cinetica delle molecole di un corpo e si manifesta con le sensazioni di caldo
e di freddo note ad ognuno di noi.
Consideriamo un pezzo di ferro. Esso, contrariamente alle apparenze, è formato da numerosissimi "pezzettini" in
continua agitazione. La temperatura misura proprio questa agitazione. Immaginiamo che i "pezzettini" siano assolutamente
immobili: la temperatura sarà un bello zero assoluto (pari a circa -273 gradi centigradi); questa
temperatura, per noi impossibile anche da immaginare, è molto più diffusa di quanto si pensi: negli enormi
spazi interstellari fa, infatti, piuttosto freddo.
Noi terrestri, che riceviamo calore sia dal sole che dal centro della terra, siamo abituati a temperature ben superiori e preferiamo utilizzare una scala diversa da quella assoluta: la scala Celsius, che misura la temperatura in gradi centigradi.
Arbitrariamente abbiamo stabilito che, la particolare temperatura alla quale l'acqua gela vale 0 gradi centigradi (0° C),
mentre quella alla quale la stessa acqua entra in ebollizione vale 100° C.
Come già visto per la pressione, anche per la temperatura si può parlare allora di valori negativi
(inferiori a 0° C) o positivi (superiori a 0° C).
Anche se, dalla scoperta del fuoco, siamo diventati dei maestri nel trasferire calore (scaldare corpi freddi, raffreddare
corpi caldi), non tutti sanno con precisione in quali modi differenti (ben 4) il calore può trasferirsi da una
zona all'altra o da un corpo all'altro.
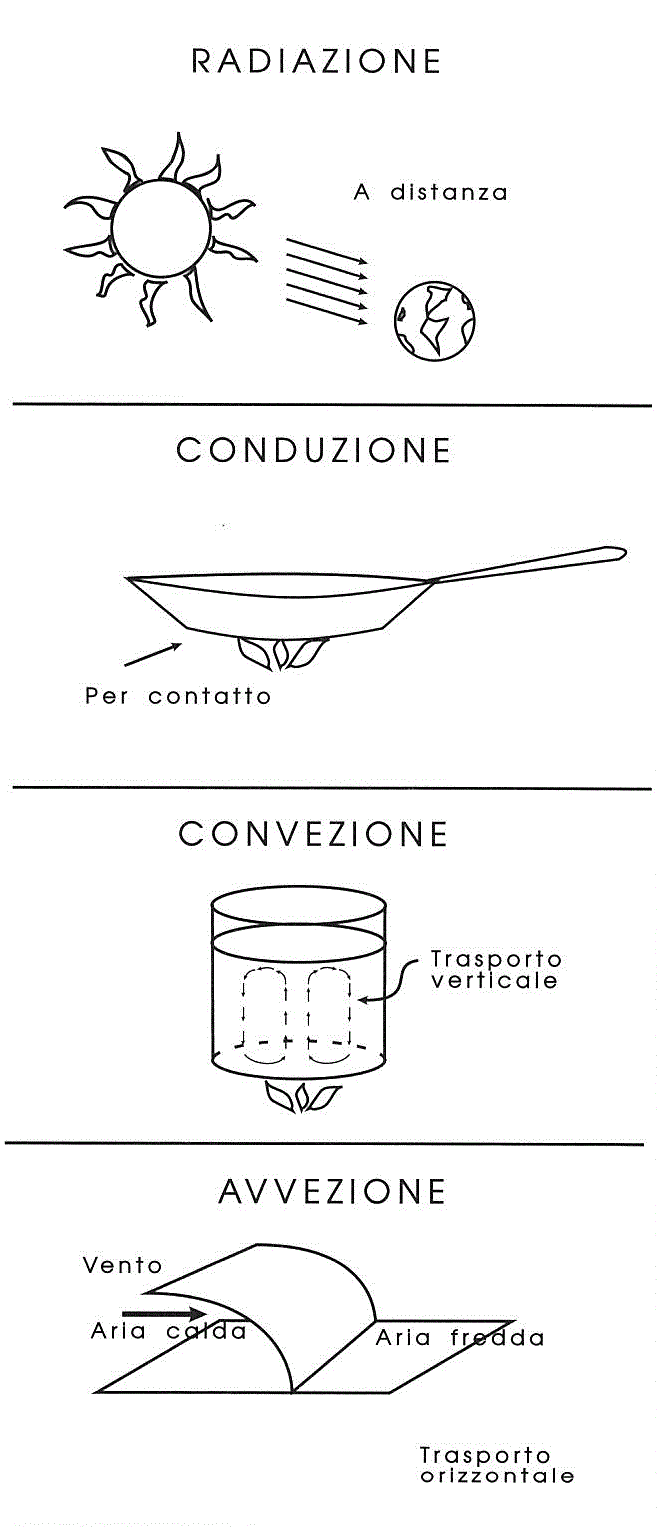
Figura 4-2. Le quattro modalità di trasmissione del calore.
Lo studio della fisica dei gas ha dimostrato che queste due grandezze sono strettamente interdipendenti: comprimendo un gas questo si scalda, mentre alleggerendo la pressione (dilatandolo) si raffredda. Pensiamo alla pompa per biciclette, nella quale avvengono successive compressioni (ad ogni pompata): l'aria si scalda e scalda la pompa (come sa chiunque abbia mai gonfiato in questo modo una gomma).
Naturalmente vale anche il contrario: riscaldando un gas aumenta la sua pressione e raffreddandolo questa diminuisce.
Questo semplice rapporto è fondamentale per la comprensione dei fenomeni termici, in aerologia.
L'acqua, come sappiamo, esiste in tre stati: solido (il ghiaccio), liquido (l'acqua appunto) e gassoso (il vapore acqueo). Vale forse la pena di sottolineare che il vapore acqueo è un gas trasparente e, per tale motivo, invisibile; le nubi, dunque, non sono fatte di vapore acqueo: erano vapore acqueo, ma sono diventate acqua o ghiaccio (sottoforma di minuscole goccioline sospese) e sono quindi diventate visibili.
L'aria che ci circonda contiene sempre, sia pur in misura maggiore o minore, del vapore acqueo; infatti, se il passaggio tra acqua e ghiaccio (congelamento) avviene soltanto a temperature molto prossime allo zero, il passaggio tra acqua e vapore acqueo (evaporazione) avviene a tutte le temperature (i panni stesi si asciugano senza bollire!).
L'umidità dell'aria indica proprio la quantità di acqua, sotto forma di vapore acqueo, che è contenuta nell'aria in un dato momento.
La capacità dell'aria di "contenere" vapore acqueo non è però costante, ma varia con la temperatura (a dire il vero varia anche con la pressione, ma per il momento possiamo ignorare questo fatto): l'aria calda riesce a contenere più vapore acqueo di quella fredda. Cosa succede comunque quando l'aria, ormai troppo "piena" di vapore acqueo (si dice satura), non riesce a "contenerne" dell'altro? Succede che il vapore acqueo di troppo condensa, tornando acqua.
Proprio per il fatto che l'aria è in grado di contenere quantità anche molto diverse di vapore acqueo si utilizzano due parametri (anzichè uno solo) per misurare l'umidità: si parla, infatti, di umidità assoluta e di umidità relativa.
Per noi più importante, ci dice quanta acqua è contenuta in una massa d'aria, esprimendola come percentuale rispetto al massimo contenibile da quella stessa aria alla stessa temperatura.
Come al solito serviamoci di un esempio: in una bottiglia piena di acqua per metà e chiusa con un tappo, l'acqua tende ad evaporare (cioè a trasformarsi in vapore acqueo ed a passare nell'aria sovrastante) e continua a farlo fino ad aver esaurito le capacità dell'aria di contenere ulteriore vapore acqueo. Dopo un po' di tempo, dunque, l'aria nella bottiglia diviene satura: la sua umidità relativa è dunque del 100% (l'aria contiene tutto il vapore acqueo che è in grado di contenere a quella temperatura).
Durante questo processo, tuttavia, c'è sicuramente stato un momento nel quale l'aria conteneva esattamente la metà del vapore acqueo in grado di saturarla.
A quel punto l'umidità relativa dell'aria nella bottiglia era del 50% (l'aria conteneva cioè la metà del vapore acqueo che poteva contenere a quella temperatura).
Bene, ora vediamo la cosa da un secondo punto di vista. Immaginiamo di avere, nella solita bottiglia, soltanto aria con umidità relativa del 50% e che la temperatura della bottiglia (e dell'aria) sia di 30 gradi. Dal momento che non c'è altra acqua disponibile l'umidità relativa non varia, a patto che non si cambi la temperatura.
Se invece abbassiamo la temperatura si abbasserà anche la capacità dell'aria di contenere vapore acqueo: il vapore acqueo già presente costituisce ora una percentuale maggiore rispetto a quella realmente contenibile; il risultato del nostro abbassamento di temperatura è un aumento dell'umidità relativa (Fig. 4-3).
Continuando ad abbassare la temperatura si giunge ad un punto in cui la massima quantità di vapore acqueo contenibile diventa uguale al vapore acqueo che già c'è (e che rappresentava inizialmente soltanto il 50%). L'aria, a questo punto, è satura o, se preferiamo, la sua umidità relativa è giunta al 100%, senza che sia mai stato aggiunto vapore acqueo dall'esterno.
Per pura curiosità continuiamo ancora ad abbassare la temperatura: l'aria "non ce la fa più" nemmeno a contenere il vapore acqueo già presente, ed una parte di questo condensa, tornando acqua e diventando visibile (velo opaco sul vetro, goccioline).
Da quanto detto dovrebbe essere chiaro che, data una massa d'aria contenente una certa quantità di vapore acqueo, è sempre possibile trovare una temperatura (per quanto bassa) alla quale una parte del vapore acqueo condensa.
Tale temperatura viene detta temperatura del punto di rugiada (o, più semplicemente, punto di rugiada) ed è caratteristica di una particolare massa d'aria (di cui siano note temperatura ed umidità relativa).
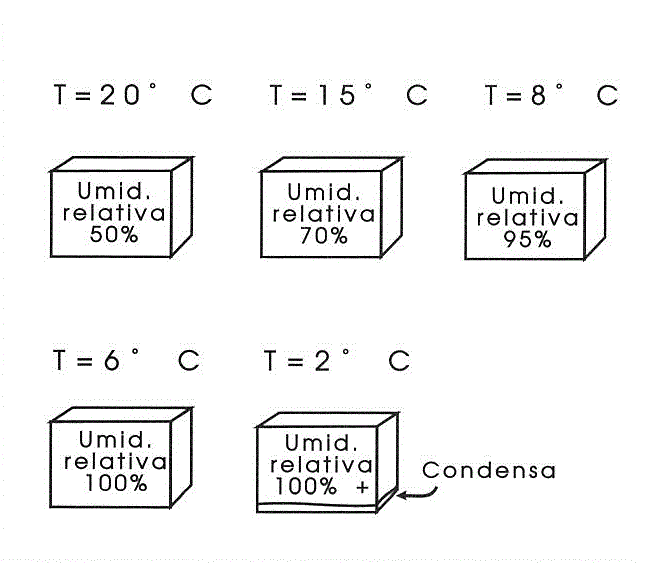
Figura 4-3. L'umidità relativa varia al variare della temperatura.
Focalizziamo ora la nostra attenzione su due passaggi cruciali: la trasformazione dell'acqua in vapore acqueo (evaporazione) e il suo contrario, cioè la trasformazione del vapore acqueo ad acqua (condensazione).
Si tratta di passaggi che comportano sempre scambi di calore; più precisamente: l'evaporazione sottrae calore all'ambiente, mentre la condensazione lo restituisce. Un modo (davvero molto artigianale) per conoscere la direzione del vento si fonda proprio su questo principio: si infila un dito in bocca (per inumidirlo) e poi lo si alza sopra la testa. Il vento proviene dal lato del dito che sente più freddo. Il metodo funziona proprio perchè il lato esposto al vento subisce una evaporazione più intensa e, quindi, si raffredda di più. Fin qui tutto bene, ma dov'è finito quel calore rubato al nostro dito? Apparentemente è scomparso; esso verrà restituito nel preciso istante in cui (chissà quando ed in quale parte del mondo) lo stesso vapore acqueo che ora si è formato, condenserà. Fino a quel momento è una sorta di "cambiale di calore" che il vapore acqueo deve al mondo.
Questo "calore che non c'è" viene detto calore latente di condensazione, ed è proporzionale alla quantità assoluta di vapore acqueo presente nell'aria.
Per misurare l'umidità assoluta si fanno passare quantità note di aria in circuiti chiusi contenenti sostanze in grado di assorbire il vapore acqueo (igrometri). L'umidità relativa si misura invece con lo psicrometro igrometrico, un nome complicato per uno strumento molto semplice:
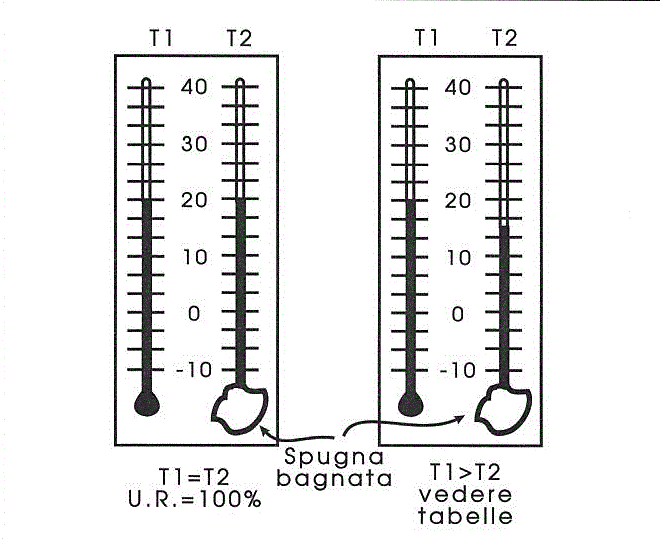
Figura 4-4. Funzionamento dello psicrometro igrometrico (la lettura dell'umidità relativa viene effettuata su apposite tabelle).